Tavola periodica sconosciuta Parte 3
contenuto
L'ultima puntata dell'articolo sulla tavola periodica, fatta eccezione per quella scolastica (corrisponde al titolo dell'intera collana). Oggi sui gruppi della tavola periodica solitamente trascurati, elementi artificiali di cui non sappiamo praticamente nulla, e su ciò che ci aspetta nell'ottavo periodo.
, due file, di solito poste sotto la lavagna, sono trattate con disprezzo a scuola - l'insegnante si limiterà a menzionarne l'esistenza e passerà ad altri elementi "più importanti". Completamente inadeguati per la funzione che svolgono nel mondo moderno. arte i Plutone () costituiscono la base dell'energia nucleare: una fonte affidabile in qualsiasi condizione climatica (a differenza dell'energia non tradizionale) e, se utilizzata correttamente, è sicura e rispettosa dell'ambiente. I lantanidi sono attualmente una materia prima strategica necessaria in molte tecnologie avanzate, ad esempio, l'elettronica moderna non esisterebbe senza i lantanidi. Ma anche adesso, entrambi i gruppi sono difficili da decifrare a causa della legge della periodicità.
Problema n. 1: Lantanidi
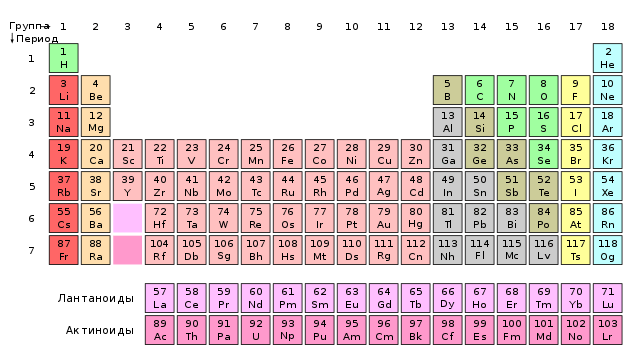
Mendeleev conosceva solo pochi lantanidi e senza troppe difficoltà riuscì ad inserirli nella tabella (1). Negli anni successivi, tuttavia, le scoperte di tali metalli sfidarono la stessa legge della periodicità. Richiede che gli elementi successivi si trovino in gruppi adiacenti e abbiano valenze diverse. Nel frattempo, i lantanidi con masse atomiche leggermente diverse (il che significava che dovevano stare uno dopo l'altro in una fila continua) avevano sempre una valenza uguale a III (alcuni anche II o IV), cioè erano nello stesso gruppo. Molte teorie sono state avanzate lantanidi, ad esempio, erano tutti considerati lo stesso elemento in versioni diverse. Il problema è stato risolto posizionando i lantanidi in una "scatola" del sistema, ma solo la meccanica quantistica degli anni '20 e '30 ha spiegato la loro posizione nella tavola periodica.
1. Cerio, il lantanide più comune. Tutti gli altri lantanidi sono simili e sembrano alluminio ()
Il problema con i lantanidi è ancora rilevante oggi. Non si sa infatti con quale elemento inizino e finiscano. Secondo la maggior parte dei libri di testo, il lantanio, sebbene abbia dato il nome all'intera famiglia, non gli appartiene: lo è scandaloso del gruppo 3i lantanidi sono metalli dal cerio al lutezio. Tuttavia, opinioni opposte indicano che l'ultimo membro della famiglia scansiona molto meglio. pregare. Le sue proprietà fisiche e la natura chimica dei composti risultanti corrispondono meglio a quelle di altri elementi del gruppo 3 (quindi, i lantanidi sono metalli dal lantanio all'itterbio). Le discussioni tra chimici continuano ancora oggi e gli autori di libri presentano la posizione di questi elementi in modi diversi (2).
2. La forma più lunga della tavola periodica. I lantanidi e gli attinidi iniziano subito dopo il gruppo 2 e gli scandler includono lutezio e laurene.
Problema n. 2: attinidi
attinidi, cioè elementi da attinio a Lorenzo, costituiscono un gruppo simile ai lantanidi, collocati nel periodo successivo. Il problema con gli attinidi era e rimane lo stesso dei lantanidi. Mendeleev conosceva solo due attinidi e li elencò senza difficoltà nella tabella (3). Tor con la valenza più forte, il gruppo IV è andato al gruppo di titanio e zirconio e al gruppo VI con il valore uranio si trova in compagnia di cromo, molibdeno e tungsteno.
Le scoperte a cavallo tra il XIX e il XIX secolo hanno scioccato il sistema: è apparso una dozzina di elementi radioattivi. Alcuni di loro avevano le stesse masse, ma proprietà diverse, mentre altri avevano le stesse proprietà - masse diverse. Questo fatto contraddiceva le conoscenze precedenti, ma la scoperta degli isotopi ha chiarito alcuni problemi. La maggior parte degli elementi si è rivelata essere miscele di atomi con masse diverse (ma, ovviamente, con lo stesso numero di protoni nel nucleo). Tornando agli attinidi, due di loro sono apparsi all'inizio del secolo scorso. L'attinio si è immediatamente rivelato simile al lantanio (la sua radioattività è stata trovata nei sedimenti di lantanidi precipitati da soluzioni contenenti attinio) e il protoattinio è caduto nel gruppo con vanadio, niobio e tantalio come elemento di valore V. Fino agli anni '40, i primi quattro attinidi si trovavano tranquillamente in gruppi da 3 a 6.
3. Gli attinidi più comuni: a sinistra c'è il torio, ricoperto da uno strato di biossido, a destra c'è l'uranio ()
Il problema è sorto durante l'attuazione del Progetto Manhattan. Fisici e chimici erano sicuri di aver prodotto elementi più pesanti dell'uraniotuttavia, non sono stati in grado di rilevare la loro presenza con mezzi chimici. Ad esempio: l'elemento 93 accanto all'uranio non si comportava come un membro del gruppo 7. È stato solo il suggerimento di Glen Seaborg, un successivo scopritore di diversi elementi transuranici, che gli elementi che iniziano con l'attinio formano file simili ai lantanidi hanno risolto il problema (4 ). L'uso dei metodi sviluppati per la separazione dei lantanidi, principalmente la cromatografia, ha permesso negli anni successivi di identificare elementi artificiali. La perfezione della tecnologia e l'abilità degli sperimentatori è testimoniata dal fatto che la presenza di alcuni nuovi elementi è stata scoperta solo con una dozzina dei loro atomi! (cinque).
Ma non credere che il torio o l'uranio abbiano improvvisamente cambiato le loro proprietà e siano diventati metalli trivalenti simili ai lantanidi. Hanno ancora più cose in comune con titanidi e cromo che con altri attinidi. Allo stesso modo con i protattinati e persino con alcuni transuranisti. Di una certa somiglianza si può parlare solo nella seconda metà della serie. Tuttavia, non si può dire che i lantanidi e gli attinidi siano famiglie imparentate (come se la loro collocazione nella tavola periodica suggerisse la loro posizione).
4. Glenn Seaborg (1912-99) dà il simbolo dell'elemento che porta il suo nome.
5. Il luogo di nascita di molti transuranisti è il ciclotrone del Lawrence Berkeley National Laboratory (agosto 1939)
Nessun dato sperimentale
La conoscenza imprecisa delle proprietà dei transuranidi più pesanti è associata a una quantità insufficiente di materiale per la ricerca. L'ultimo elemento ad essere prodotto in una notevole quantità di milligrammi è einstein, al 99° posto della classifica. Naturalmente, gli esperimenti vengono effettuati anche con altri transuranidi, ma nel loro caso, ad esempio, viene studiata la radiazione caratteristica che si forma nel precipitato e non si osserva la formazione di cristalli dei composti.
Proprietà fisico-chimiche non può essere semplicemente misurato, ma solo stimato da osservazioni indirette. Un problema simile si verifica con due elementi più leggeri: astatu (n. 85) i francese (n. 87). A causa della loro breve durata, le quantità visibili non sono state ancora ottenute e la teoria deve colmare le lacune nelle osservazioni e nelle misurazioni. D'altra parte, la produzione annuale di plutonio, che si trova in tracce nella crosta terrestre, è di diverse tonnellate ed è meglio compresa di molti degli elementi persistenti più leggeri.
Un problema ancora più grande è con gli elementi più pesanti con un periodo di 7 dopo gli attinidi. Nel loro caso, si deve operare con atomi letteralmente separati, la cui durata è calcolata in frazioni di secondo. Non è più possibile determinare la radioattività presente nel precipitato di un composto legato ad un elemento, ma solo indagare su determinate proprietà fisiche (come la velocità di deposizione su una data superficie) e quindi trarre conclusioni sulla somiglianza chimica. Certo, aiuta la teoria, o meglio i calcoli basati sulla meccanica quantistica. Tuttavia, i risultati non sono affidabili al 100%, ad esempio, secondo una certa distribuzione di elettroni sui gusci, la descrizione delle proprietà chimiche è ancora lontana. Più ci allontaniamo dai dati di osservazione diretta, più inaffidabile diventa la conclusione del "Metodo di Mendeleev" (cioè basato sulle proprietà degli elementi noti).
Chimici e fisici stanno cercando di prevedere le proprietà anche degli elementi più pesanti, ma non ancora ottenuti, del prossimo periodo. Gli elementi 119 e 120 avranno probabilmente caratteristiche non molto diverse da quelle situate al di sopra del francio e del radio (nei gruppi 1 e 2, il cambiamento delle proprietà fisico-chimiche è del tutto naturale). Nel periodo 8, come i lantanidi e gli attinidi, ci saranno ben 18 proprietà molto simili degli elementi del blocco g che gli scienziati non hanno ancora affrontato.
I calcoli suggeriscono l'esistenza di elementi con una valenza fino a 12 durante questo periodo.Probabilmente, l'elemento 164 sarà nel sistema, per quelli più pesanti la carica nucleare sarà così grande che gli elettroni cadranno su di essi e la velocità orbitale supererebbe la velocità della luce. I calcoli effettuati non danno risultati univoci, alcuni spostano i confini della tavola periodica di una dozzina di elementi.
La legge della periodicità nella spazzatura?
Dopo aver letto l'articolo, probabilmente sei giunto alla conclusione che un gran numero di eccezioni dalle regole impartite a scuola, questo ti dà il diritto di rispondere affermativamente alla domanda. Ma non darlo troppo in fretta. Legge di periodicità è formulato in modo molto generale (le proprietà vengono periodicamente ripetute), che è sia il suo vantaggio che lo svantaggio. Il vantaggio, infatti, analizzando la posizione di un elemento in una tabella costruita in base alla legge, si possono trarre conclusioni sulle sue proprietà fisiche e chimiche. Uno svantaggio, in quanto le conclusioni sono spesso imprecise o addirittura false.
Legge di periodicità funziona bene nei gruppi principali (1, 2, 13-18), meglio nelle loro parti superiori che in quelle inferiori. Un esempio perfetto è il periodo 3: dal sodio all'argon, la valenza e le proprietà chimiche cambiano regolarmente senza sorprese. Nei gruppi laterali (3-12) le deviazioni sono già chiaramente visibili, ma sopra hai letto dei problemi con lantanidi e attinidi. In generale, più lontano dall'inizio del sistema, meno esattamente è soddisfatta la legge della periodicità.
Quindi nella spazzatura? Universo di elementi chimici e le relazioni che creano sono un sistema così complesso che nemmeno la brillante idea di Mendeleev non riesce a catturarlo del tutto. La legge ha certamente bisogno di essere rettificata e chiarita. Se confrontiamo Mendeleev con Newton (poiché sia la legge della periodicità che la teoria della gravità hanno organizzato e spiegato grandi porzioni del mondo intorno a noi), possiamo concludere che i chimici stanno ancora aspettando il loro Einstein.
Vedi anche:

