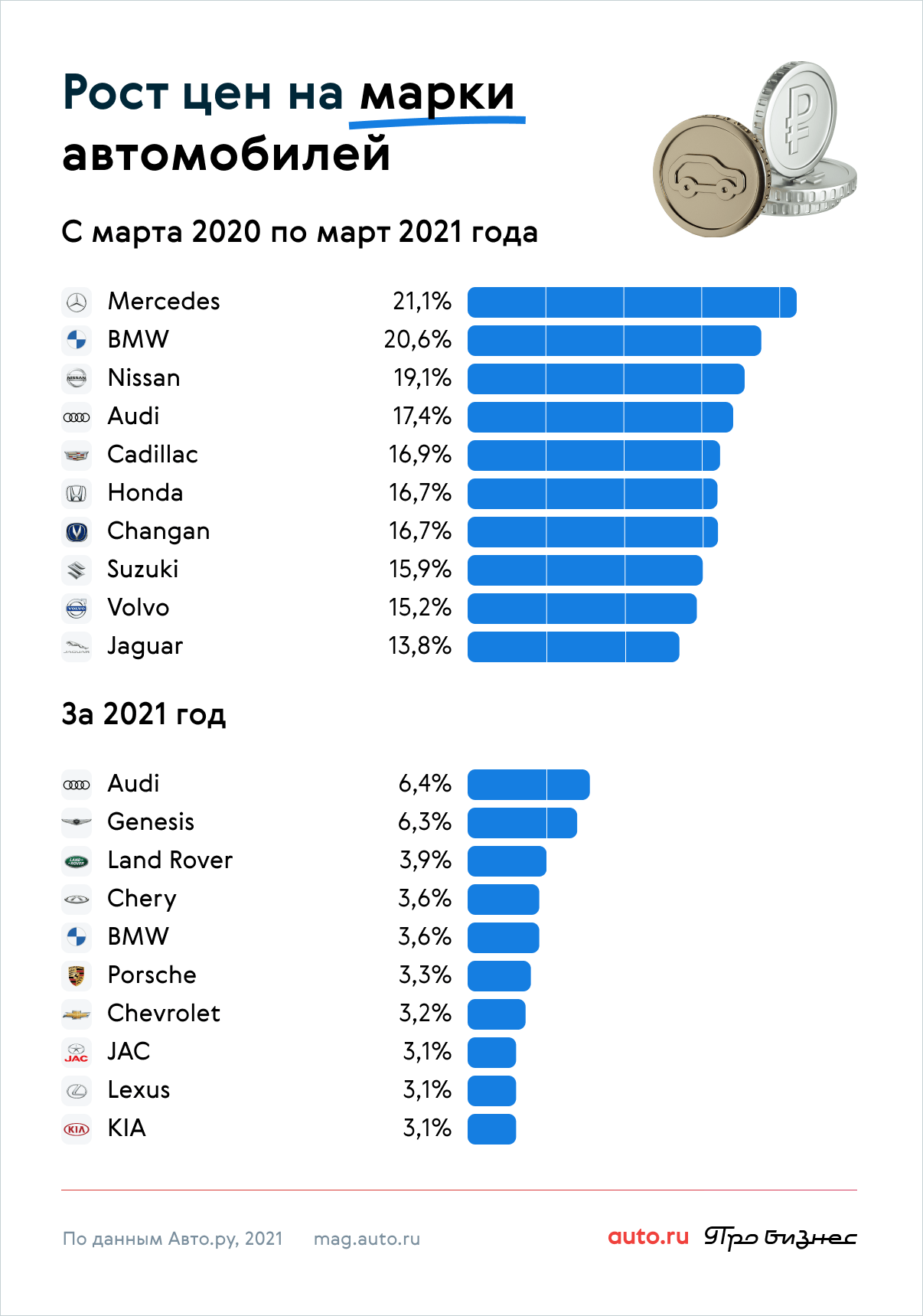
Un bicchiere d'acqua
Il vetro liquido è una soluzione concentrata di metasilicato di sodio Na2SiO3 (viene utilizzato anche il sale di potassio). Si ottiene sciogliendo la silice (come la sabbia) in una soluzione di idrossido di sodio:
Un bicchiere d'acqua si tratta infatti di una miscela di sali di vari acidi silicici con diversi gradi di polimerizzazione. Viene utilizzato come impregnante (ad esempio per proteggere le pareti dall'umidità, come protezione antincendio), come componente di stucchi e sigillanti, per la produzione di materiali siliconici, nonché come additivo alimentare per prevenire l'agglomerazione (E 550). Il vetro liquido disponibile in commercio può essere utilizzato per diversi esperimenti spettacolari (poiché è un liquido denso e sciropposo, viene utilizzato diluito 1:1 con acqua).
Nel primo esperimento precipiteremo una miscela di acidi silicici. Per il test utilizzeremo le seguenti soluzioni: vetro liquido e cloruro di ammonio NH.4Cl e carta indicatrice per verificare la reazione (foto 1).
Chimica - parte di vetro liquido 1 - MT
Il vetro liquido come sale di un acido debole e una base forte in una soluzione acquosa è in gran parte idrolizzato ed è alcalino (foto 2). Versare la soluzione di cloruro di ammonio (foto 3) nel becher con la soluzione di bicchiere d'acqua e mescolare il contenuto (foto 4). Dopo qualche tempo si forma una massa gelatinosa (foto 5), che è una miscela di acidi silicici:
(in realtà SiO2?2DI ? si formano acidi silicici con vari gradi di idratazione).
Il meccanismo di reazione del becher rappresentato dall'equazione riassuntiva di cui sopra è il seguente:
a) il metasilicato di sodio in soluzione si dissocia e subisce idrolisi:
b) gli ioni ammonio reagiscono con gli ioni idrossido:
Poiché gli ioni ossidrile vengono consumati nella reazione b), l'equilibrio della reazione a) si sposta a destra e, di conseguenza, gli acidi silicici precipitano.
Nel secondo esperimento, coltiviamo "impianti chimici". Per l'esperimento saranno necessarie le seguenti soluzioni: vetro liquido e sali di metallo? ferro (III), ferro (II), rame (II), calcio, stagno (II), cromo (III), manganese (II).
Chimica - parte di vetro liquido 2 - MT
Iniziamo l'esperimento introducendo diversi cristalli di sale di cloruro di ferro (III) FeCl in una provetta.3 e una soluzione di vetro liquido (foto 6). Dopo un po', le piante? (foto 7, 8, 9), da metasilicato di ferro (III) insolubile:
Inoltre, i sali di altri metalli consentono di ottenere risultati efficaci:
- rame (II)? foto 10
- cromo (III)? foto 11
- ferro (II)? foto 12
- calcio? foto 13
- manganese (II)? foto 14
- stagno (II)? foto 15
Il meccanismo dei processi in atto si basa sul fenomeno dell'osmosi, ovvero la penetrazione di piccole particelle attraverso i pori delle membrane semipermeabili. I depositi di silicati metallici insolubili si formano come uno strato sottile sulla superficie del sale introdotto nella provetta. Le molecole d'acqua penetrano nei pori della membrana risultante, facendo dissolvere il sale metallico sottostante. La soluzione risultante spinge il film fino a farlo scoppiare. Dopo aver versato la soluzione di sale metallico, il precipitato di silicato precipita nuovamente? il ciclo si ripete e l'impianto chimico? aumenta.
Mettendo una miscela di cristalli di sale di vari metalli in un recipiente e annaffiandola con una soluzione di vetro liquido, possiamo far crescere un intero "giardino chimico"? (foto 16, 17, 18).
foto